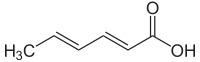
Asam sorbat
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Asam (2E,4E)-heksa-2,4-dienoat
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C6H8O2 | |
| Massa molar | 112,13 g·mol−1 |
| Titik lebur | 135 °C (275 °F; 408 K) |
| Titik didih | 228 °C (442 °F; 501 K) |
| Keasaman (pKa) | 4.76 pada 25 °C |
| Bahaya | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Asam sorbat, atau Asam 2,4-heksadienoat, adalah sebuah senyawa organik yang digunakan sebagai bahan pengawet makanan. Senyawa ini memiliki rumus kimia C6H8O2. Senyawa ini merupakan sebuah padatan tak berwarna yang agak larut di dalam air dan mampu menyublim dengan cepat. Senyawa ini pertama kali diisolasi dari buah beri yang belum matang pada pohon rowan (Sorbus aucuparia), sehingga senyawa ini dinamai berdasarkan hal tersebut.
Produksi
[sunting | sunting sumber]Jalur sintesis tradisional asam sorbat melibatkan kondensasi asam malonat dan trans-butenal. Senyawa ini dapat pula dibuat dari isomerik asam heksadienoat, yang tersedia melalui reaksi berkatalis-nikel dari alil klorida, asetilena, dan karbon monoksida. Jalur sintesis yang digunakan secara komersial, tetapi, adalah berasal dari krotonaldehida dan ketena.[1] Diestimasi sekitar 30,000 ton diproduksi setiap tahun.[2]
Sejarah
[sunting | sunting sumber]Asam sorbat pertama kali diisolasi pada tahun 1859 melalui distilasi minyak beri rowan oleh A. W. von Hofmann. Distilasi tersebut menghasilkan lakton dari asam sorbat, yang mana ia konversikan menjadi asam sorbat melalui hidrolisis. Aktivitas antimikrobanya diketahui pada akhir tahun 1930-an dan 1940-an, dan menjadi tersedia secara komersial di akhir 1940-an dan 1950-an. Di awal tahun 1980-an, asam sorbat dan garamnya digunakan sebagai inhibitor Clostridium botulinum dalam produk daging untuk menggantikan penggunaan nitrit, yang dapat memproduksi nitrosamina karsinogenik.[3]
Sifat dan kegunaan
[sunting | sunting sumber]Dengan nilai pKa sebesar 4.76, senyawa ini berada pada rentang asam yang hampir serupa dengan asam asetat.
Asam sorbat dan garamnya, seperti natrium sorbat, kalium sorbat, dan kalsium sorbat, merupakan agen antimikroba yang biasa digunakan sebagai bahan pengawet dalam produk makanan dan minuman untuk mencegah pertumbuhan kapang, khamir, dan fungi. Secara umum garam-garam sorbat lebih disukai dibanding bentuk asamnya karena kelarutannya yang lebih di dalam air, tetapi bentuk aktifnya adalah asam. Nilai pH optimum untuk aktivitas antimikroba berada di bawah pH 6.5. Sorbat secara umum digunakan pada konsentrasi 0.025% hingga 0.10%. Penambahan garam sorbat ke dalam makanan akan, tetapi, agak sedikit meningkatkan pH makanan tersebut sehingga pH dapat butuh disesuaikan untuk menjamin keamanan pangan tersebut. Senyawa ini juga ditemukan pada berbagai makanan, seperti keju dan roti.
Nomor E dari jenis senyawaan ini adalah:
- E200 Asam sorbat
- E201 Natrium sorbat
- E202 Kalium sorbat
- E203 Kalsium sorbat
Beberapa jenis kapang (diantaranya beberapa galur Trichoderma dan Penicillium) dan khamir mampu mendetoksifikasi sorbat melalui dekarboksilasi, menghasilkan trans-1,3-pentadiena. Pentadiena tersebut berwujud sebagai bau yang khas pada minyak tanah atau minyak bumi. Reaksi detoksifikasi lainnya melibatkan reduksi membentuk 4-heksenol dan asam 4-heksenoat.[4]
Asam sorbat juga dapat digunakan sebagai aditif pada karet, dan sebagai produk antara pada produksi pembuatan plasticizer dan pelumas.[5]
Keamanan
[sunting | sunting sumber]Nilai LD50 dari asam sorbat diperkirakan berada pada 7.4 dan 10 g/kg, yang mana nilai tersebut cukup tinggi. Senyawa ini relatif tidak stabil dan secara cepat terdegradasi dalam tanah, karenanya senyawa ini terkadang dianggap ramah lingkungan.[2]
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Ashford's Dictionary of Industrial Chemicals, Third edition, 2011, page 8482
- ^ a b Erich Lück, Martin Jager and Nico Raczek "Sorbic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2000.doi:10.1002/14356007.a24_507
- ^ A. S. Naidu, ed. (2000). Natural food antimicrobial systems. hlm. 637. ISBN 0-8493-2047-X.
- ^ Kinderlerer JL, Hatton PV (1990). "Fungal metabolites of sorbic acid". Food Addit Contam. 7 (5): 657–69. doi:10.1080/02652039009373931. PMID 2253810.
- ^ Bingham E, Cohrssen B (2012). Patty's Toxicology. John Wiley & Sons. hlm. 547.
